Effectivité du neurofeedback sur le trouble du spectre autistique – Une étude de cas
- 1Pratique psychologique, Graz, Autriche
- 2Recherche scientifique médicale, BEE Medic GmbH, Singen, Allemagne
- 3Cabinet médical, Bienne, Suisse
Le trouble du spectre autistique (TSA) est un trouble neuronal et mental du développement qui a un impact sur la connectivité cérébrale et le traitement de l’information. Bien qu’il ait été démontré que l’application de la procédure de neurofeedback à infra-basse fréquence (ILF) entraîne des changements significatifs dans la connectivité fonctionnelle dans de multiples zones et réseaux neuronaux du cerveau, des données assez limitées sont disponibles dans la littérature sur l’efficacité de cette technique dans un contexte thérapeutique pour traiter les TSA. Nous présentons ici l’étude de cas d’un garçon de 5 ans atteint de TSA, qui a reçu un traitement de 26 séances de neurofeedback ILF sur une période de 6 mois. Un suivi systématique et quantitatif des principaux symptômes de TSA dans plusieurs catégories a été utilisé pour documenter les changements de comportement au fil du temps. L’intervention de neurofeedback ILF a diminué la gravité moyenne des symptômes de chaque catégorie à un degré remarquable, avec l’effet le plus fort (réduction moyenne de la gravité de 80 et 77%) pour les symptômes physiques et du sommeil et l’influence la plus faible sur les symptômes comportementaux (réduction moyenne de la gravité de 15%). Cette étude de cas est représentative de l’expérience clinique et montre donc que le neurofeedback ILF est un instrument thérapeutique pratique et efficace pour traiter les TSA chez les enfants.
Introduction
Le trouble du spectre autistique (TSA) est un trouble du développement neuronal et mental qui apparaît tôt et qui dure toute la vie (DSM-5/CIM-11). Les caractéristiques de base sont des déficiences de la communication sociale déjà présentes dans l’enfance et des comportements restrictifs et répétitifs. Le degré de gravité des troubles du langage et des troubles cognitifs varie, la majorité des personnes touchées ayant des capacités inférieures à la moyenne. Quatre-vingt pour cent des personnes touchées ont au moins un trouble comorbide qui affecte de manière significative l’évolution de la symptomatologie. Le trouble est souvent associé à une qualité de vie considérablement réduite ainsi qu’à un fardeau familial élevé.
La diversité pathologique et l’hétérogénéité des TSA reposent sur une interaction complexe de la génétique, des expositions environnementales et des physiopathologies systémiques, qui ont toutes eu un impact sur la connectivité cérébrale et le traitement de l’information (Holiga et coll., 2019; Cheroni et coll., 2020; Carroll et coll., 2021; Panisi et coll., 2021).
Il a récemment été démontré que le neurofeedback ILF produit des changements significatifs dans la connectivité fonctionnelle dans de multiples zones et réseaux neuronaux du cerveau (Dobrushina et al., 2020). L’utilisation de cette variante de neurofeedback pour le traitement des TSA est donc raisonnable, d’autant plus que son développement méthodologique a été basé sur des résultats cliniques (Othmer et al., 2011) et qu’il est inclus dans les recommandations de traitement fondées sur des preuves pour de nombreux troubles mentaux. L’objectif de cette étude de cas est de démontrer l’efficacité du neurofeedback ILF dans l’autisme tout en soulignant la nécessité de poursuivre la recherche clinique sur les changements physiologiques cérébraux associés.
Méthode
Cas clinique
Ceci est un rapport sur les procédures et les impacts d’un traitement clinique de neurofeedback ILF de six mois sur un garçon de 5 ans « E » atteint de TSA, qui avait reçu son diagnostic à l’âge de 2,7 ans sur la base de plusieurs instruments d’évaluation: « Diagnostic Interview for Autism (ADI-R) », « Diagnostic Observation Scale for Autistic Disorders (ADOS 2, Module 1) » et « Questionnaire de communication sociale » (« Fragebogen zur Sozialen Kommunikation (FSK) – Eltern »).
Méthodes de neurofeedback ILF
Les origines du neurofeedback, qui consiste à mesurer les ondes cérébrales sous forme d’électroencéphalogramme (EEG), à les décomposer en leurs composantes de fréquence (« bandes de fréquences »), puis à convertir leurs amplitudes en signaux de rétroaction audiovisuels, remontent aux années 1970 (Sterman, 1973). Le neurofeedback ILF a été principalement développé empiriquement, sur la base d’observations cliniques provenant de protocoles d’entraînement en « bande de fréquences » et de ces méthodes de neurofeedback qui utilisaient des potentiels corticaux lents (SCP) dans la gamme de fréquences EEG inférieure à 0,1 Hz, appelée gamme ILF (Othmer et Othmer, 2016). Le protocole de traitement appliqué du neurofeedback ILF capture dans un EEG à bande complète enregistré en continu à la fois l’évolution temporelle du potentiel de surface dans la gamme ILF et les densités de puissance supra-seuil de neuf bandes de fréquences discrètes dans la gamme spectrale de 0,5 à 40 Hz et traite tout cela en signaux de rétroaction audiovisuelle pour le patient (Legarda et al., 2011; Othmer et coll., 2011; Othmer, 2015; Othmer et Othmer, 2016; Grin-Yatsenko et coll., 2018).
Les seuils des neuf bandes de fréquences s’ajustent individuellement et dynamiquement de sorte que la densité de puissance EEG dominante d’une bande de fréquences est inférieure au seuil environ 95% du temps. Grâce à cette méthode, une augmentation soudaine de la densité de puissance dans l’une des neuf bandes de fréquences conduit immédiatement à des valeurs supraseuils et donc à un renforcement d’un certain ensemble de signaux de rétroaction audiovisuels (« inhibits »). Dans le même temps, la dynamique dans la gamme ILF est également suivie (« signal d’entraînement ») et couplée à un deuxième ensemble de signaux de rétroaction audiovisuels (« Signal »). Pour la détermination de la composante ILF, le thérapeute doit définir un facteur d’amplification individuel via une fréquence de coupure de filtre passe-bas. Le protocole de neurofeedback ILF spécifie en outre un montage bipolaire pour l’enregistrement EEG. Ainsi, ce n’est pas l’activité cérébrale changeant dynamiquement sous chacune des deux électrodes, mais plutôt leur différence, qui est le signal ciblé; et par conséquent, le neurofeedback ILF cible directement les relations de réseau et représente donc un entraînement à la cohérence.
Nomenclature de position des électrodes 10/20
Dans cette étude, nous suivons la nomenclature standard de position des électrodes 10/20 de l’American Clinical Neurophysiology Society. Cette nomenclature a subi quelques changements dans sa dernière mise à jour en 2016, qui affectent également certaines des positions d’électrodes couramment utilisées dans le neurofeedback ILF. Étant donné que cette revue utilise encore souvent les anciennes désignations, nous tenons à souligner que l’emplacement réel de « T8 » correspond à l’ancienne terminologie « T4 ».
Système d’enregistrement EEG et montage
Le neurofeedback clinique a utilisé le protocole de neurofeedback ILF développé par Othmer et al. (2011), Othmer et Othmer (2016), Othmer (2015) et instrumenté par le système Cygnet, qui consistait en un amplificateur EEG différentiel à 2 canaux « NeuroAmp II » (Corscience, Allemagne), ainsi que le logiciel Cygnet (BEE Medic, Allemagne). Ce système s’intègre au retour d’animation vidéo (Somatic Vision, États-Unis), fonctionne sur un ordinateur avec le système d’exploitation Windows 10 et utilise un moniteur haute résolution supplémentaire pour afficher les animations vidéo.
Chaque séance de neurofeedback consistait en un enregistrement EEG différentiel continu à bande complète à 2 canaux qui a été réalisé à l’aide d’un montage d’électrodes bipolaires au placement T8-P4, avec une électrode supplémentaire à Cz pour référence (des deux canaux) et une électrode de mise à la terre à Fpz. Avant de placer des électrodes, la peau de la zone de placement a été nettoyée par une pâte abrasive (Nuprep, Weaver and Company, États-Unis). Ensuite, Ten20 Conductive Paste (Weaver and Company, États-Unis) a été utilisé pour maintenir les électrodes en place et pour assurer de faibles impédances (<5 kΩ) de toutes les électrodes.
Suivi des symptômes
Pour évaluer les changements de symptômes grâce à la thérapie de neurofeedback ILF, nous avons utilisé l’outil de suivi des symptômes en ligne d’EEG Expert (www.eegexpert.net), qui a comme élément central un catalogue de 137 symptômes des catégories du sommeil, du comportement d’attention et d’apprentissage, sensoriel et perception, comportement, émotions, symptômes physiques et douleur. Pour une enquête initiale, la gravité de chacun des 137 symptômes donnés doit être évaluée selon une échelle allant de 0 (le symptôme ne s’applique pas du tout) à 10 (le symptôme survient très fréquemment ou est prononcé au maximum). Pour suivre les changements de symptômes pendant et après la fin de l’intervention clinique, le thérapeute peut sélectionner jusqu’à 25 symptômes, pour lesquels une gravité particulièrement élevée a été indiquée dans l’enquête initiale ou pour lesquels il existe un intérêt clinique particulier, pour des enquêtes ultérieures.
Les parents de « E » ont été invités à suivre les symptômes individuels de son fils avant (enquête 1 le 16 octobre 2018) et après (enquête 2 le 30 avril 2019) l’intervention de neurofeedback. Entre les deux points de mesure se trouvait la phase de 26 séances d’intervention de neurofeedback ILF. Après l’évaluation initiale de la gravité des symptômes, un total de 23 symptômes présentant les niveaux de gravité les plus élevés ont été sélectionnés pour la deuxième enquête. Le tableau 1 montre les 23 symptômes sélectionnés à cette étape avec les niveaux de gravité évalués aux deux points temporels des enquêtes.
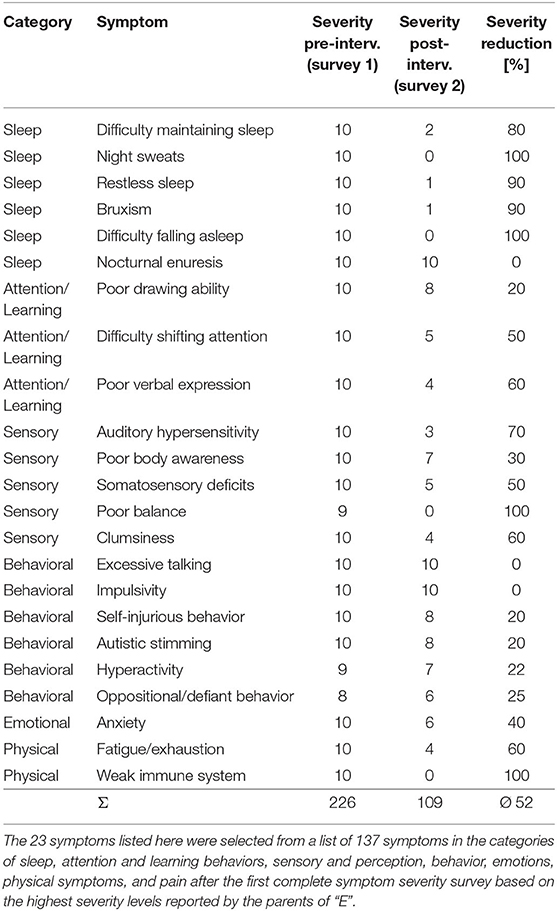
TABLEAU 1. Liste de tous les symptômes suivis de « E » avec évolution de la gravité avant le début (enquête 1, 16 octobre 2018) et après (gravité 2, 30 avril 2019) la fin de l’intervention avec neurofeedback ILF.
Présentation initiale
Lors de l’entrevue initiale, la mère de « E » a déclaré qu’il avait fait preuve d’un manque d’engagement social, comme à la maternelle, n’approchant pas activement les autres enfants pour qu’ils participent à leurs activités ou leur demandent de participer à des activités conjointes.
De plus, « E » ne jouait pas seul, ne faisait pas semblant de jouer et n’imitait pas le comportement des gens; Mais il avait déjà commencé à imiter le comportement des dessins animés. De plus, « E » avait des difficultés à exprimer ses sentiments et à maintenir un contact visuel avec d’autres personnes. De plus, lorsqu’il se sentait excité ou fatigué, il battait des mains et adoptait un comportement autodestructeur tel que se mordre les doigts. Sa mère a également signalé des problèmes avec l’heure du coucher et le sommeil: « E » avait du mal avec l’heure du coucher le soir et avait des crises de colère toute la nuit, qui duraient environ 3 à 5 heures avec des effondrements occasionnels. Les autres symptômes signalés comprenaient la sensibilité au bruit, le bruxisme, l’incontinence de jour comme de nuit, la réactivité émotionnelle, la peur et l’attachement. « E » présentait des problèmes de coordination et n’était, par exemple, pas capable d’utiliser correctement les pédales de son tracteur de jeu pour le conduire. De plus, il n’avait pas atteint les jalons appropriés à son âge dans le développement de son langage et de son élocution; Au lieu de cela, il a exprimé des sons spécifiques et difficiles à comprendre et les a répétés de manière excessive.
Séances de traitement 1 à 12 : Approche initiale et justification
Formation initiale côté droit aux sites temporo-pariétaux T8-P4
Pour traiter les symptômes rapportés de « E » avec le neurofeedback ILF, des électrodes EEG ont été placées au début de toutes les séances d’entraînement sur le côté droit de son crâne aux sites temporo-pariétal T8-P4, car ce placement est connu pour calmer les hypersensibilités sensorielles, améliorer l’intégration sensorielle et augmenter la conscience socio-émotionnelle et l’empathie (Othmer, 2015).
Au début des interventions de neurofeedback ILF « E » ne permettait pas au thérapeute d’attacher des électrodes et les enlevait à plusieurs reprises. Par conséquent, il a été récompensé par des bonbons sans sucre pour chaque électrode qu’il a permis au thérapeute d’attacher des électrodes à sa tête.
Grâce à cette procédure, il est devenu possible de mener une première séance de neurofeedback ILF. « E » a regardé un court métrage (pendant 12 minutes) où la rétroaction a été donnée via une modulation dynamique de la taille de la fenêtre vidéo en fonction de la force de l’activité EEG enregistrée dans la gamme de fréquences du signal d’entraînement (ILF).
Ajustements en fonction des indications cliniques
Les sessions deux et trois ont été utilisées pour ajuster le réglage de la fréquence du signal d’entraînement ILF afin de trouver sa fréquence de réponse optimale (ORF) et de prolonger la durée de la session à 15 min. Avant la séance de neurofeedback suivante, sa mère a signalé une amélioration notable des performances de sommeil de « E ».
Après la quatrième séance de neurofeedback, « E » a de nouveau éprouvé des difficultés à s’endormir la nuit et, par conséquent, le réglage de la fréquence du signal d’entraînement ILF a été ajusté lors de la cinquième session.
Impacts observés
À la fin de la première session, aucun changement notable dans « E » n’a pu être observé. Cependant, sa mère a rapporté plus tard qu’environ 1 heure après la séance, elle avait pu commander de la nourriture dans un service au volant McDonald’s pour la toute première fois sans qu’il crie et crie de peur de la voix du haut-parleur.
La nuit suivant l’ajustement ORF lors de la cinquième séance de neurofeedback, il a exceptionnellement bien dormi pendant 10,5 heures sans interruption. Selon les rapports de ses parents, l’humeur de « E » le matin s’était également améliorée à un degré remarquable et il avait commencé à se réveiller heureux et détendu.
Parallèlement à l’amélioration du sommeil, « E » a réussi pour la première fois à utiliser correctement les pédales et le volant de son tracteur pour enfants, et a ainsi pu conduire correctement le tracteur. De plus, il a récemment ajouté le nouveau mot « Tante » (allemand pour « tante ») à son vocabulaire.
Après huit séances de neurofeedback, « E » a commencé à s’engager dans des jeux de rôle. Dans un scénario imaginaire spécifique, il s’imaginait dans le rôle du thérapeute et son client était son ours en peluche. De plus, il a imité toute la procédure de la séance d’entraînement en neurofeedback sur son ours en peluche, notamment en insistant pour placer des électrodes sur la tête de l’ours en peluche. Il a même récompensé l’ours en peluche avec des bonbons après le placement de chaque électrode EEG.
Séances de traitement 13 à 26 : Mise en place des électrodes à T8-P4 et T8-F8
Pour cibler son retard de développement de la parole et déclencher la production de la parole, un deuxième entraînement avec des placements d’électrodes frontales-temporales droites à T8-F8 pendant 15 min a été ajouté à partir de la 13e session directement après 15 minutes d’entraînement pariétal droit à T8-P4.
Impacts observés
« E » a produit 33 nouveaux mots tels que « Bärli », « Mona », « Romi », etc. De plus, après la 26e session, il a produit la phrase de quatre mots: « Papa ist zu Hause » (allemand pour « Papa est à la maison »).
La mère de « E » a signalé les changements suivants chez son fils pendant toute la durée de l’entraînement en neurofeedback ILF (16 octobre 2018-30 avril 2019) : « Le battement de main a diminué et ne se produit plus que dans des moments vraiment excitants, par exemple, lorsqu’il regarde un film pour la première fois ou lorsqu’il est avec de nombreux amis ou d’autres personnes. De plus, il a atteint de façon spectaculaire les jalons de la parole et est devenu capable de produire des phrases de trois à quatre mots, qui se composaient principalement de noms, mais ont également lentement commencé à impliquer des verbes.
Il était également remarquable qu’il recommençait à chanter des chansons (qu’il avait arrêtées quand il avait environ deux ans) et devenait de plus en plus conscient du sens des paroles. De plus, il a commencé à respecter clairement les règles et à préférer tout faire tout seul. De plus, il est devenu capable de nous dire verbalement ou par des gestes quelle partie de son corps lui faisait mal. Selon moi, les changements obtenus chez mon fils grâce à l’entraînement en neurofeedback sont clairs et significatifs.
Fin du traitement
Après que les parents de « E » aient estimé que les objectifs de la thérapie de neurofeedback ILF avaient été atteints, ils ont décidé d’arrêter le traitement après la 26e séance.
Résultats
Après la première enquête sur la gravité des symptômes par les parents de « E » avant le début de l’intervention de l’ONF, les symptômes ayant obtenu les scores d’évaluation les plus élevés ont été sélectionnés pour une réévaluation après la fin du traitement. Le résultat est présenté dans le tableau 1 et indique que certains symptômes avec une gravité maximale évaluée initiale, comme les sueurs nocturnes, la difficulté à s’endormir et d’autres, avaient complètement disparu au cours de l’intervention avec le neurofeedback ILF. Cependant, la gravité évaluée des symptômes de l’énurésie nocturne, de l’impulsivité et de la parole excessive n’a pas du tout été affectée par l’intervention. La réduction globale de la gravité des 23 symptômes sélectionnés en raison de l’intervention de neurofeedback ILF était de 52%.
Pour déterminer quelles zones présentent les plus grands changements de symptômes, les 23 symptômes individuels qui avaient les scores les plus élevés dans l’enquête initiale ont été regroupés dans les catégories Sommeil, Attention/apprentissage, Sensoriel, Comportemental, Émotionnel et Physique (voir le tableau 2, Figure 1). L’entraînement en neurofeedback ILF a diminué la gravité moyenne des symptômes de chaque catégorie à un degré remarquable, avec l’effet le plus fort (80% et 77% de réduction moyenne de la gravité) pour les symptômes physiques et de sommeil et l’influence la plus faible (réduction moyenne de la gravité de 15%) sur les symptômes comportementaux.
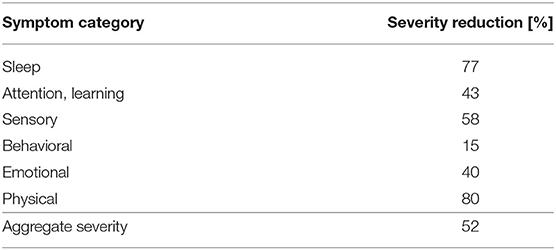
TABLEAU 2. Réduction globale de la gravité pour l’ensemble du groupe de symptômes au cours de 26 séances de neurofeedback.
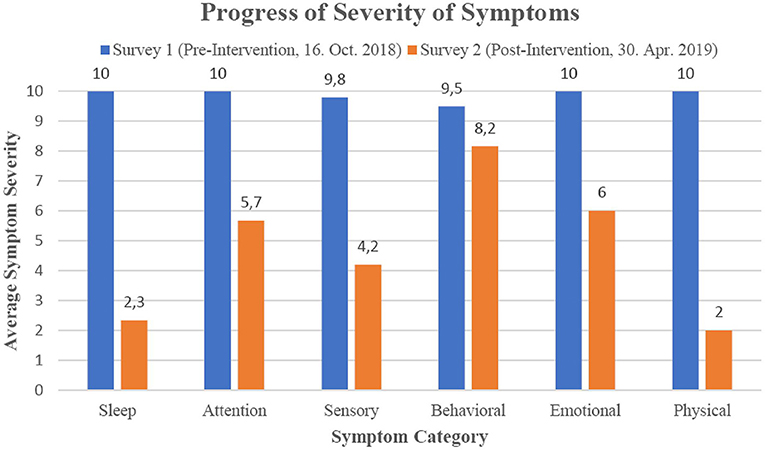
GRAPHIQUE 1. Progression du pourcentage de réduction des symptômes catégorisés par l’intervention de neurofeedback ILF.
Discussion
Dans le cas de « E », l’intervention de neurofeedback ILF de 26 séances sur une période de 6,5 mois sur des sites d’entraînement d’électrodes T8-P4 et à la fréquence de réponse optimale individuelle dans la plage ILF inférieure à 0,1 Hz, avait clairement conduit à un apaisement physique général et à une réduction de son niveau d’excitation ainsi qu’à une amélioration de la flexibilité et de la stabilité de la régulation de l’état. En conséquence, la plupart de ses problèmes de sommeil s’étaient considérablement améliorés au cours de la période d’intervention. Des améliorations distinctes ont également été enregistrées dans les domaines du comportement social et de la coordination corporelle au cours de l’intervention.
Après l’ajout d’une position d’électrode plus frontale à T8-F8 dans la seconde moitié de l’entraînement, « E » a montré des améliorations remarquables dans sa perception corporelle et le développement de la parole. Des changements de symptômes comparables dans le développement du langage après une intervention de neurofeedback ILF ont été rapportés dans une description de cas d’un enfant de 4 ans atteint de TSA (Sasu, 2020). La restriction à un placement d’électrode purement hémisphérique droite à partir de la 13e séance de neurofeedback pour promouvoir le développement linguistique de « E » a sa raison d’être dans la conclusion empirique qu’une telle formation est souvent la clé de l’émergence du langage chez les enfants atteints de TSA (Othmer et Othmer, 2011). Ce groupe de patients présentant des déficits de développement de la petite enfance ou des problèmes de filtrage sensoriel bénéficie généralement d’un entraînement en neurofeedback ILF du côté droit, qui est systématiquement démontré par des améliorations des fonctions cérébrales éloignées de la mise en place des électrodes ou localisées dans l’hémisphère gauche. Ainsi, « E » montre également une amélioration de la gravité des symptômes de 60% par rapport à son expression linguistique par un placement d’électrode purement hémisphérique droite, même si la production du langage et les réseaux spécifiques au langage sont généralement localisés dans l’hémisphère gauche. Il convient toutefois de noter que les structures corticales, dont les activités EEG sont converties en signaux de rétroaction audiovisuelle lors du neurofeedback ILF, ne représentent pas nécessairement les zones cérébrales affectées par l’entraînement. De manière constante, dans une étude IRMf contrôlée avec 53 sujets sains, Dobrushina et ses collègues montrent après un entraînement en neurofeedback ILF purement droit aux sites d’électrodes T4-P4 a significativement augmenté la connectivité sur les deux hémisphères entre la saillance, le langage et les réseaux visuels, en particulier dans certaines parties de l’aire de Broca et de la région de Wernicke (Dobrushina et al., 2020 ). Nous concluons que cette description de cas ne peut pas fournir une explication plus détaillée de la découverte intéressante d’une amélioration de l’expression linguistique après un traitement de neurofeedback ILF du côté droit et que d’autres recherches cliniques sont nécessaires.
Les changements de gravité susmentionnés sont également évidents pour de nombreux autres symptômes de « E », comme l’ont révélé les deux enquêtes sur la gravité des symptômes avant le début et après le début de l’intervention de neurofeedback ILF. Les symptômes initialement considérés comme les plus graves ont été atténués de 52% après l’évolution du neurofeedback. Un regroupement des symptômes a révélé que « E » pouvait bénéficier de l’entraînement en neurofeedback en particulier dans la catégorie des symptômes physiques et du sommeil (80 et 77%, respectivement). En comparaison, le changement de gravité des symptômes comportementaux au cours de l’intervention de neurofeedback était beaucoup plus faible (15%), bien que ceux-ci aient également diminué. Il s’agit d’une découverte intéressante, car la littérature clinique sur les effets du neurofeedback dans les TSA tend à conclure que cette méthode de traitement traite les symptômes spécifiques au TDAH, tels que l’hyperactivité ou le contrôle des impulsions (pour la revue, voir Holtmann et al., 2011). Mais il faut mentionner que des protocoles nettement différents du neurofeedback ILF ont été utilisés dans ces études. Cependant, une étude de l’effet du neurofeedback ILF chez les enfants et les adolescents atteints de TDAH montre des améliorations significatives des symptômes spécifiques au TDAH (Schneider et al., 2021), ce qui démontre que cette méthode de neurofeedback peut en principe affecter les symptômes d’hyperactivité et de contrôle des impulsions. De plus, les résultats présentés doivent être considérés à la lumière des limites de cette étude, car elle ne représente qu’une seule description de cas et la variabilité des résultats est particulièrement élevée dans l’autisme, selon notre expérience. Ainsi, d’autres études cliniques et contrôlées sont nécessaires pour clarifier les détails des effets du traitement par neurofeedback ILF sur les symptômes spécifiques au comportement chez les enfants atteints de TSA.
Conclusion
Les résultats présentés sur l’intervention chez un enfant atteint de TSA indiquent que le neurofeedback ILF est une méthode d’entraînement clinique appropriée pour traiter un large éventail de comportements autistiques caractéristiques de ce trouble du spectre chez les enfants, et qu’il peut aider à réduire leurs déficits de développement grâce à une autorégulation améliorée du système nerveux central.
Compte tenu du degré de progrès réalisé en 26 séances d’intervention de neurofeedback ILF sur 6 mois, la méthode semble être rentable et cliniquement efficace. Il aborde également directement les mécanismes de connectivité essentiels aux TSA, jetant ainsi les bases de nouvelles améliorations avec la maturation. Par conséquent, le neurofeedback ILF mérite d’être approfondi, y compris des études de cas et des études cliniques contrôlées abordant les détails du protocole et les mécanismes sous-jacents, dans le but de jeter les bases d’une mise en œuvre plus large.
Déclaration de disponibilité des données
Les contributions originales présentées dans l’étude sont incluses dans l’article / matériel supplémentaire, les demandes supplémentaires peuvent être adressées au(x) auteur(s) correspondant(s).
Contributions de l’auteur
AR: thérapeute de E et co-auteur. HS : responsable de la partie technique de l’étude de cas et co-auteur. WP: responsable des aspects pédopsychiatriques dans l’étude de cas et co-auteur. Tous les auteurs ont contribué à l’article et approuvé la version soumise.
Conflit d’intérêts
HS était employé par BEE Medic Gmbh Allemagne.
Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Note de l’éditeur
Toutes les affirmations exprimées dans cet article sont uniquement celles des auteurs et ne représentent pas nécessairement celles de leurs organisations affiliées, ni celles de l’éditeur, des éditeurs et des évaluateurs. Tout produit qui peut être évalué dans cet article, ou toute allégation qui peut être faite par son fabricant, n’est pas garanti ou approuvé par l’éditeur.
Références
Carroll, L., Braeutigam, S., Dawes, J. M., Krsnik, Z., Kostovic, I., Coutinho, E., et coll. (2021). Troubles du spectre autistique : voies multiples et conséquences multiples de la fonction synaptique et de la connectivité anormales. Neuroscientifique 27, 10-39. doi : 10.1177/1073858420921378
Cheroni, C., Caporale, N., et Testa, G. (2020). Le trouble du spectre autistique à la croisée des gènes et de l’environnement : contributions, convergences et interactions dans la physiopathologie développementale des TSA. Mol. Autisme 11, 69. doi: 10.1186/s13229-020-00370-1
Dobrushina, O. R., Vlasova, R. M., Rumshiskaya, A. D., Litvinova, L. D., Mershina, E. A., Sinitsyn, V. E., et coll. (2020). Modulation de la connectivité cérébrale intrinsèque par neurofeedback électroencéphalographique implicite. Avant. Hum. Neurosci. 14, 192. doi : 10.3389/fnhum.2020.00192
Grin-Yatsenko, V. A., Ponomarev, V. A., Kara, O., Wandernoth, B., Gregory, M., Ilyukhina, V. A., et coll. (2018). « Effet du neurofeedback infra-basse fréquence sur les fluctuations EEG infra-lentes », dans Biofeedback, ed M. Schwartz (IntechOpen Limited), 5. doi : 10.5772/intechopen.77154
Holiga, Š., Hipp, J. F., Chatham, C. H.,, P., Spooren, W., D’Ardhuy, X. L., et coll. (2019). Les patients atteints de troubles du spectre autistique présentent des altérations reproductibles de la connectivité fonctionnelle. Sci. trad. Med. 11, EAAT9223. doi: 10.1126/scitranslmed.aat9223
Holtmann, M., Steiner, S., Hohmann, S., Poustka, L., Banaschewski, T., et Bölte, S. (2011). Neurofeedback dans les troubles du spectre autistique. Dev. Med. Enfant Neurol. 53, 986–993. doi: 10.1111/j.1469-8749.2011.04043.x
Legarda, S. B., McMahon, D., Othmer, S., et Othmer, S. (2011). Neurofeedback clinique: études de cas, mécanisme proposé et implications pour la pratique de la neurologie pédiatrique. J. Enfant Neurol. 26, 1045. doi : 10.1177/0883073811405052
Othmer, S., et Othmer, S. (2016). Neurofeedback infra-basse fréquence pour des performances optimales. Biofeedback 44, 81-89. doi : 10.5298/1081-5937-44.2.07
Othmer, S., Othmer, S., et Legarda, S. B. (2011). Neurofeedback clinique: entraînement du comportement cérébral. Soigner. Strateg. – Neurol. Psych. pédiatrique. 2, 67–73.
Othmer, S., et Othmer, S. F. (2011). « Neurofeedback for the autism spectrum, Chapter 44 », dans Cutting-Edge Therapies for Autism, éd. K. Siri et T. Lyons (Skyhorse Publishing), 262-267.
Othmer, S. F. (2015). Guide de protocole pour les cliniciens en neurofeedback, 5th Edn. Los Angeles, Californie: EEG Info Publications.
Panisi, C., Guerini, F. R., Abruzzo, P. M., Balzola, F., Biava, P. M., Bolotta, A., et coll. (2021). Trouble du spectre autistique de l’utérus à l’âge adulte: suggestions pour un changement de paradigme. J. Pers. 11, 70. doi : 10.3390/jpm11020070
Sasu, R. (2020). « Développement précoce et troubles émotionnels et comportementaux de l’enfance », dans Restoring the Brain, Neurofeedback as an Integrative Approach to Health, 2nd Edn, ed H. W. Kirk (Boca Raton, FL: Routledge), 179-195. doi: 10.4324/9780429275760-9
Schneider, H., Riederle, J., et Seuss, S. (2021). « Effet thérapeutique de l’entraînement neurofeedback infra-basse fréquence sur les enfants et les adolescents atteints de TDAH », dans Brain-Computer Interface, ed V. Asadpour (Londres: IntechOpen), 13. doi : 10.5772/intechopen.97938
Mots-clés: Méthode Othmer, trouble du spectre autistique (TSA), électroencéphalogramme (EEG), neurofeedback infra-basse fréquence (ILF), fréquence de réponse optimale (ORF), suivi des symptômes, échelle de gravité des symptômes
Citation: Rauter A, Schneider H et Prinz W (2022) Effectivity of ILF Neurofeedback on Autism Spectrum Disorder—A Case Study. Avant. Hum. Neurosci. 16:892296. doi: 10.3389/fnhum.2022.892296
Reçu: 08 mars 2022; Acceptée : 10 mai 2022 ;
Publication : 09 juin 2022.
Édité par:
Siegfried Othmer, EEG Info, États-UnisRevu par:
Andreas A. Ioannides, AAI Scientific Cultural Services Limited, ChypreMartha Herbert, Higher Synthesis Foundation, États-Unis
Copyright © 2022 Rauter, Schneider et Prinz. Il s’agit d’un article en libre accès distribué selon les termes de la licence Creative Commons Attribution (CC BY). L’utilisation, la distribution ou la reproduction dans d’autres forums est autorisée, à condition que l’auteur original (s) et le (s) titulaire (s) du droit d’auteur soient crédités et que la publication originale dans cette revue soit citée, conformément aux pratiques académiques acceptées. Aucune utilisation, distribution ou reproduction n’est autorisée qui n’est pas conforme à ces conditions.
*Correspondance: Wolfgang Prinz, wolfgang.prinz@mzb-cmb.ch
Démenti: Toutes les affirmations exprimées dans cet article sont uniquement celles des auteurs et ne représentent pas nécessairement celles de leurs organisations affiliées, ni celles de l’éditeur, des éditeurs et des évaluateurs. Tout produit qui peut être évalué dans cet article ou toute allégation qui peut être faite par son fabricant n’est pas garanti ou approuvé par l’éditeur.



 Alexandra Rauter
Alexandra Rauter Horst Schneider
Horst Schneider Wolfgang Prinz
Wolfgang Prinz