ÉCRIT PAR
Kajal Patel, Manoj Sivan, James Henshaw et Anthony Jones
Déposée: juillet 14th, 2020 Commentaire envoyé le 31 août 2020 Publié: octobre 6th, 2020
DOI : 10.5772/intechopen.93826
Résumé
Le neurofeedback est une nouvelle thérapie neuromodulatrice où les individus reçoivent une rétroaction en temps réel concernant leurs signaux neurophysiologiques cérébraux afin d’augmenter le contrôle volontaire de leur activité cérébrale. Une telle plate-forme de biofeedback peut être utilisée pour augmenter la résilience d’un individu à la douleur, car la douleur chronique a été associée à un traitement central anormal des signaux de douleur ascendants. Le neurofeedback peut être fourni sur la base d’enregistrements d’électroencéphalogramme (EEG) ou d’imagerie par résonance magnétique fonctionnelle (IRMf) d’un individu. Les rythmes cérébraux cibles couramment utilisés dans le neurofeedback EEG pour la douleur chronique comprennent les rythmes thêta, alpha, bêta et sensorimoteur. Il a été démontré qu’une telle formation améliore non seulement la douleur dans diverses affections douloureuses telles que la douleur neuropathique centrale, la fibromyalgie, les lésions cérébrales traumatiques et la neuropathie périphérique induite par la chimiothérapie, mais qu’elle améliore également les symptômes associés à la douleur tels que le sommeil, la fatigue, la dépression et l’anxiété. Les événements indésirables associés à l’entraînement en neurofeedback sont souvent spontanément résolutifs et disparaissent avec une fréquence d’entraînement réduite. La prestation d’une telle formation a également été explorée à domicile, où les individus ont été encouragés à la pratiquer au besoin, avec des résultats prometteurs. Par conséquent, le neurofeedback a le potentiel de fournir une approche holistique et peu coûteuse de la gestion de la douleur chronique.
1. Introduction
Neurofeedback [1, 2] est une plateforme intelligente de biofeedback qui fournit une rétroaction en temps réel aux individus sur leurs signaux neurophysiologiques afin d’obtenir une activité cérébrale associée à un bénéfice thérapeutique. L’activité cérébrale d’un individu est mesurée en continu à l’aide d’un système EEG au cours de l’entraînement en neurofeedback et les paramètres décrivant les signaux neurophysiologiques tels que la puissance alpha ou la fréquence alpha maximale sont calculés en temps réel [3]. Ces caractéristiques calculées de l’activité cérébrale continue sont ensuite présentées à l’individu sous forme audio ou visuelle [3]. L’idée sous-jacente est que grâce à la fourniture répétée d’une telle rétroaction, l’individu acquiert une conscience de son état cérébral actuel et peut identifier différentes stratégies mentales qui l’aident à atteindre l’état cérébral souhaité [4]. Une fois que l’individu a identifié les stratégies qui fonctionnent pour lui, il peut continuer à les pratiquer au cours de plusieurs séances dans le but final de pouvoir mettre en œuvre ces stratégies indépendamment d’une séance de neurofeedback.
Le neurofeedback a déjà fait l’objet d’études approfondies pour la prise en charge de plusieurs affections neuropsychiatriques [5] comme le trouble déficitaire de l’attention avec hyperactivité (TDAH) [6], la dépression et l’anxiété [7], la cognition [8] et la réadaptation après un AVC [9] par exemple. Être capable de cibler les signaux cérébraux grâce au neurofeedback peut être très bénéfique dans des conditions telles que la douleur chronique. En effet, la perception de la douleur chronique dépend de la façon dont plusieurs régions du cerveau traitent les signaux de douleur ascendants [10, 11]. Un certain nombre d’études ont montré qu’un tel traitement centralisé des signaux de douleur entrants était différent chez les patients souffrant de douleur chronique par rapport aux participants en bonne santé [12, 13, 14]. Étant donné que le cerveau joue un rôle si important dans le développement et le maintien de l’état de douleur chronique, être capable de cibler les changements dans le signal neurophysiologique qui reflètent une telle activité cérébrale en utilisant une nouvelle thérapie telle que le neurofeedback est d’un grand intérêt.
Le domaine de la thérapie par neurofeedback pour la douleur chronique se développe rapidement. Plusieurs études ont été réalisées sur une gamme de conditions médicales au cours de la dernière décennie [15]. Les études actuelles sont très hétérogènes avec un certain nombre de variations dans le protocole et la prestation du neurofeedback [15, 16]. Ce chapitre vise à donner un aperçu des changements neurophysiologiques observés dans la douleur chronique et comment ceux-ci ont été ciblés par différentes études de neurofeedback. Nous discutons également des différents aspects des protocoles de neurofeedback qui ont été utilisés jusqu’à présent et des résultats de ces études en termes de réduction de la douleur et des symptômes associés à la douleur.
2. Voies neuronales sous-jacentes à la perception de la douleur
Notre compréhension des neurosciences sous-jacentes à la douleur a considérablement évolué au fil du temps. Les voies neuronales impliquées dans la perception de la douleur ont été montrées chez Graphique 1. L’une des premières théories expliquant la douleur était la « théorie de la spécificité » (Graphique 1: Voie rouge). Selon cette théorie, la douleur est ressentie lorsqu’une blessure à une partie particulière du corps conduit à des signaux relayés par des neurones nociceptifs au « centre de la douleur » [17]. Le cerveau était considéré comme un « récepteur passif de l’information sensorielle » [17].
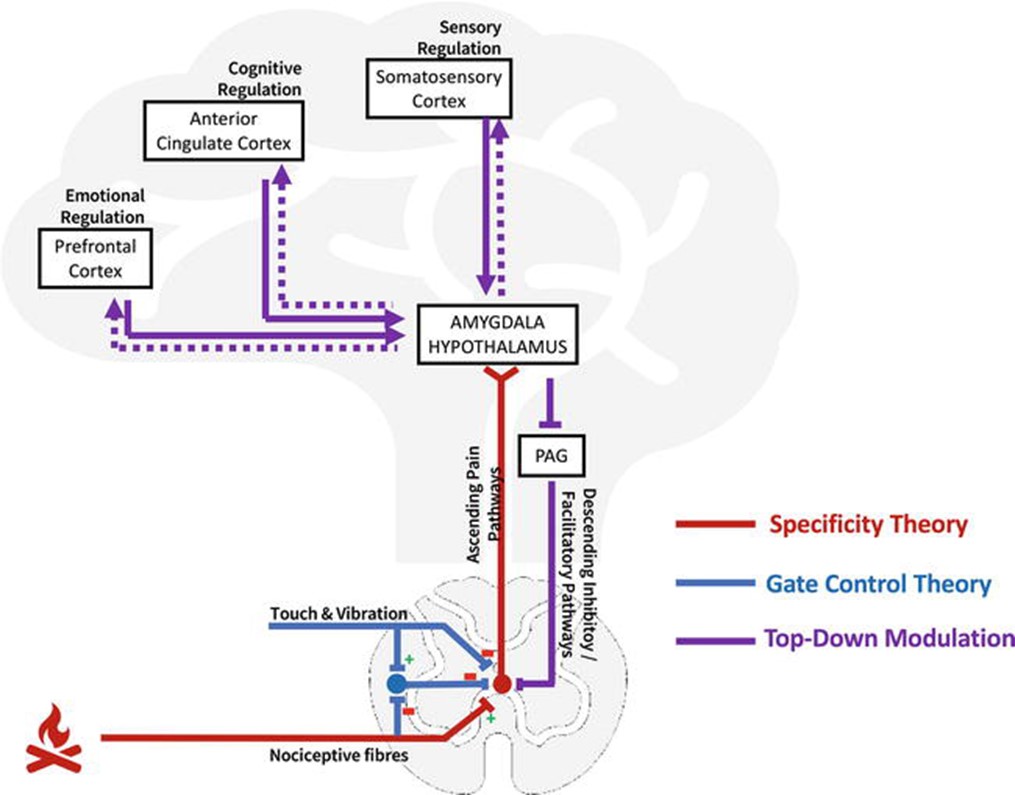
Graphique 1.
Voies neuronales sous-jacentes à la perception de la douleur proposées par différentes théories de la douleur.
L’une des théories marquantes qui a eu une grande influence sur le changement de cette compréhension antérieure de la douleur a été la théorie du contrôle des portes de Melzack et Wall (1965) [18] (Graphique 1: Voie bleue). Cette théorie proposait que plusieurs neurones de la moelle épinière, tels que de grosses fibres transportant des sensations tactiles et vibratoires ainsi que des interneurones dans la substance gélatinosa de la corne dorsale, modulent les signaux entrants du site de la douleur, influençant ainsi le signal final qui est transmis au cerveau pour traitement.
Depuis lors, les progrès de la neuroimagerie ont révélé qu’en plus des voies neuronales dans la moelle épinière, plusieurs structures corticales sont également impliquées dans la modulation de la perception de la douleur [19, 20] (Graphique 1: Voie violette). Certaines des zones qui ont été signalées comme étant impliquées comprennent le gyrus cingulaire antérieur, le cortex somatosensoriel, le cortex insulaire, le thalamus et le cortex préfrontal [19]. Ces résultats suggèrent qu’il n’y a pas un seul « centre de la douleur ». Au lieu de cela, la douleur est traitée par une « matrice de douleur » reliant différentes parties du cerveau, renforçant ainsi l’idée que la perception de la douleur est le résultat de plusieurs processus sensoriels, affectifs et cognitifs [10, 11]. Par conséquent, la douleur ressentie par un individu est une intégration de l’information actuelle sur la stimulation sensorielle douloureuse et de l’information préalable provenant d’expériences antérieures qui influencent les émotions, l’anxiété, l’attention et les attentes de l’individu au sujet de la douleur [21].
Différentes zones du cortex constituant la matrice de la douleur projettent sur l’hypothalamus et l’amygdale, qui donnent alors lieu à la fois à des voies inhibitrices descendantes et à des voies facilitatrices descendantes [21, 22]. Ces voies descendantes se projettent directement sur la corne dorsale de la moelle épinière où la douleur se produit, par conséquent, influence les signaux qui sont relayés par les voies ascendantes [21, 22]. Ce processus est connu sous le nom de modulation descendante de la douleur [23].
En résumé, la douleur perçue par un individu est une intégration de la façon dont les différentes parties du cortex traitent les signaux de douleur ascendants ainsi que de la façon dont l’activité de ces structures corticales et sous-corticales influence les signaux de douleur ascendants via les voies descendantes [17, 21, 24]. Avec la découverte de ces processus d’ordre supérieur qui influencent la perception de la douleur, plusieurs thérapies neuromodulatrices telles que le neurofeedback (NFB), l’hypnose et la méditation, ont été explorées avec le potentiel de contrôler la douleur en influençant ce traitement cortical supraspinal de la douleur [25].
3. Rythmes cérébraux associés à la douleur chronique
Généralement, les oscillations EEG sont classées en fonction de leur fréquence en thêta (4-7 Hz), alpha (8-12 Hz), bêta faible ou bêta1 (15–20 Hz) et bêta ou bêta élevé2 (22–30 Hz) [26, 27, 28, 29]. Une autre oscillation largement étudiée dans le domaine de la neuromodulation est le rythme sensorimoteur (SMR). SMR fait référence aux oscillations dans la gamme 12-15 Hz qui apparaissent en forme de fuseau sur le cortex sensorimoteur pendant le ralenti du cortex moteur [30, 31]. L’exécution motrice ou l’imagerie motrice qui active le cortex moteur entraîne une diminution de l’activité du SMR [31].
Chacun de ces rythmes cérébraux est associé à un état cognitif spécifique. Par exemple, alors que les ondes alpha ont été associées à un état détendu, les ondes bêta sont associées à l’éveil et à un état d’engagement dans la tâche. Les ondes thêta ont été associées à la somnolence [27, 32].
Les patients souffrant de douleur chronique présentent des différences dans leurs oscillations cérébrales au repos (EEG) par rapport aux personnes en bonne santé. Un exemple d’état de douleur chronique qui a été largement étudié pour l’identification des corrélats EEG de la douleur chronique a été la lésion de la moelle épinière (LME). Une étude de Sarnthein et al. [12] ont montré que les patients atteints de lésions médullaires souffrant de douleur neuropathique centrale présentaient une activité accrue des oscillations thêta et bêta par rapport aux patients en bonne santé. Ces résultats ont été confirmés par une autre étude [13] qui a observé des augmentations similaires de l’activité thêta et bêta, mais a également identifié des niveaux plus faibles d’activité alpha dans cette population de patients. Cette association entre la douleur chronique et les changements EEG a été encore renforcée lorsque Jensen et al. [33] a démontré que même au sein d’un groupe de patients atteints de lésions de la moelle épinière, les personnes souffrant de douleur neuropathique centrale avaient une activité thêta et alpha plus élevée que les patients atteints de lésions de la moelle épinière, mais pas de douleur chronique.
Ces profils d’EEG ont également été rapportés dans d’autres conditions de douleur chronique. Par exemple, les patients souffrant de migraine ont un pouvoir thêta et delta plus élevé que les témoins sains [14]. Il a été démontré que les patients atteints de fibromyalgie ont une activité thêta plus élevée avec des sources estimées dans le cortex préfrontal et orbitofrontal dorsolatéral gauche, une activité bêta et gamma plus élevée avec des sources estimées dans les cortex somatosensoriel insulaire, moteur primaire et primaire et secondaire et un ralentissement du pic alpha dominant [34].
L’identification de tels corrélats neurophysiologiques de la douleur chronique est importante car elle fournit non seulement le signal de rétroaction nécessaire pour augmenter le contrôle volontaire dans des thérapies telles que le neurofeedback, mais permet également de surveiller l’efficacité de la thérapie dans la modulation des processus neurophysiologiques ciblés par la thérapie.
3. Rythmes cérébraux associés à la douleur chronique
Généralement, les oscillations EEG sont classées en fonction de leur fréquence en thêta (4-7 Hz), alpha (8-12 Hz), bêta faible ou bêta1 (15–20 Hz) et bêta ou bêta élevé2 (22–30 Hz) [26, 27, 28, 29]. Une autre oscillation largement étudiée dans le domaine de la neuromodulation est le rythme sensorimoteur (SMR). SMR fait référence aux oscillations dans la gamme 12-15 Hz qui apparaissent en forme de fuseau sur le cortex sensorimoteur pendant le ralenti du cortex moteur [30, 31]. L’exécution motrice ou l’imagerie motrice qui active le cortex moteur entraîne une diminution de l’activité du SMR [31].
Chacun de ces rythmes cérébraux est associé à un état cognitif spécifique. Par exemple, alors que les ondes alpha ont été associées à un état détendu, les ondes bêta sont associées à l’éveil et à un état d’engagement dans la tâche. Les ondes thêta ont été associées à la somnolence [27, 32].
Les patients souffrant de douleur chronique présentent des différences dans leurs oscillations cérébrales au repos (EEG) par rapport aux personnes en bonne santé. Un exemple d’état de douleur chronique qui a été largement étudié pour l’identification des corrélats EEG de la douleur chronique a été la lésion de la moelle épinière (LME). Une étude de Sarnthein et al. [12] ont montré que les patients atteints de lésions médullaires souffrant de douleur neuropathique centrale présentaient une activité accrue des oscillations thêta et bêta par rapport aux patients en bonne santé. Ces résultats ont été confirmés par une autre étude [13] qui a observé des augmentations similaires de l’activité thêta et bêta, mais a également identifié des niveaux plus faibles d’activité alpha dans cette population de patients. Cette association entre la douleur chronique et les changements EEG a été encore renforcée lorsque Jensen et al. [33] a démontré que même au sein d’un groupe de patients atteints de lésions de la moelle épinière, les personnes souffrant de douleur neuropathique centrale avaient une activité thêta et alpha plus élevée que les patients atteints de lésions de la moelle épinière, mais pas de douleur chronique.
Ces profils d’EEG ont également été rapportés dans d’autres conditions de douleur chronique. Par exemple, les patients souffrant de migraine ont un pouvoir thêta et delta plus élevé que les témoins sains [14]. Il a été démontré que les patients atteints de fibromyalgie ont une activité thêta plus élevée avec des sources estimées dans le cortex préfrontal et orbitofrontal dorsolatéral gauche, une activité bêta et gamma plus élevée avec des sources estimées dans les cortex somatosensoriel insulaire, moteur primaire et primaire et secondaire et un ralentissement du pic alpha dominant [34].
L’identification de tels corrélats neurophysiologiques de la douleur chronique est importante car elle fournit non seulement le signal de rétroaction nécessaire pour augmenter le contrôle volontaire dans des thérapies telles que le neurofeedback, mais permet également de surveiller l’efficacité de la thérapie dans la modulation des processus neurophysiologiques ciblés par la thérapie.
4. Protocoles d’entraînement en neurofeedback
Il existe deux modalités clés qui ont été utilisées pour fournir un neurofeedback – le neurofeedback EEG et le neurofeedback IRMf. Alors que le neurofeedback EEG fournit une rétroaction basée sur les signaux neurophysiologiques enregistrés par un système EEG, le neurofeedback IRMf fournit une rétroaction basée sur le degré d’activation d’une région particulière du cerveau détectée à l’aide de l’imagerie IRMf en temps réel [35]. Par conséquent, il est inévitable qu’il y ait un certain décalage entre l’activation et la détection du signal dans le neurofeedback IRMf qui se produit presque instantanément dans le neurofeedback EEG [35].
Les preuves concernant l’efficacité du neurofeedback IRMf dans la douleur sont limitées, ce qui est compréhensible, en raison des difficultés et des dépenses accrues associées à cette forme. La région d’intérêt commune qui a été ciblée dans les études IRMf a été le gyrus cingulaire antérieur rostral (rACC), où une activité accrue du rACC, mesurée par la détection d’une augmentation du signal dépendant du niveau d’oxygène dans le sang de la région, a été associée à la réduction de la douleur [36, 37]. Cependant, ces études ont été sévèrement limitées en termes de nombre de séances [37, 38], par conséquent, le plein bénéfice du neurofeedback qui se produit au cours de plusieurs séances n’a pas encore été exploré dans le neurofeedback IRMf pour la douleur chronique.
Un certain nombre de rythmes cérébraux ont été ciblés par le neurofeedback EEG afin d’augmenter la résilience à la douleur (Tableau 1). Les rythmes couramment ciblés comprennent thêta (4-7 Hz), alpha (8-13 Hz), bêta (14-30 Hz) et sensorimoteur (12-15 Hz sur la zone sensorimotrice) [17]. Cependant, le changement souhaité dans chacun de ces rythmes varie. Alors que la réduction de la douleur a été associée à une augmentation de la puissance des rythmes alpha et sensorimoteurs, en revanche, une diminution des rythmes thêta et bêta a été associée au soulagement de la douleur [17]. Cependant, très peu d’études ciblent ces signaux isolément [20, 39]. Le plus souvent, les études ciblent plusieurs signaux en même temps, où les patients sont soit montrés chaque rythme individuellement en même temps, soit ils reçoivent une rétroaction basée sur le rapport de deux de ces signaux [40, 41, 42, 43].
Rythme cérébral | Fréquence | Changement souhaité |
Thêta | 4 à 7 Hz | Diminution de puissance |
Alpha | 8 à 13 Hz | Augmentation de puissance |
Bêta | 14 à 30 Hz | Diminution de puissance |
Rythme sensorimoteur | 12–15 Hz | Augmentation de puissance |
Tableau 1.
Cibles de neurofeedback [17].
En général, les séances de neurofeedback ont tendance à durer de 30 à 45 minutes et les patients se voient offrir 20 à 40 séances [15]. La fréquence de ces séances varie d’une à cinq fois par semaine, mais les études qui ont administré des séances plus fréquentes ont rapporté un plus grand soulagement de la douleur. Les électrodes couramment utilisées pour fournir une rétroaction comprennent C3, C4, Cz, T3, T4, FP1, P3 et P4 [15].
La rétroaction a été fournie de diverses façons. La rétroaction auditive a été principalement sous la forme d’un changement de volume sonore, par lequel l’obtention d’un signal a été associée à une augmentation du volume entendu [44]. La rétroaction visuelle utilisée a été plus variée (Graphique 2). Certaines études utilisent des barres simples pour montrer la rétroaction, la hauteur de la barre étant proportionnelle à l’intensité du signal [45]. D’autres études ont changé la couleur de la barre lors de l’obtention du signal de sorte que lorsque le seuil est atteint, la couleur devient verte, sinon elle reste rouge [43]. Certaines études ont tenté d’engager les utilisateurs à travers l’idée de jeux où la largeur d’une rivière augmente à mesure que l’intensité du signal augmente, par exemple [41, 46]. Par conséquent, la rétroaction a été fournie de diverses façons. Une autre forme de stimulation qui peut être explorée dans le contexte du neurofeedback est la stimulation tactile. Certaines études ont même combiné deux formes de stimuli tels que visuel et auditif par lequel on montre au patient un patient en colère et criant [36]. Afin de calmer le patient, l’individu doit réaliser les changements souhaités dans les rythmes cérébraux.
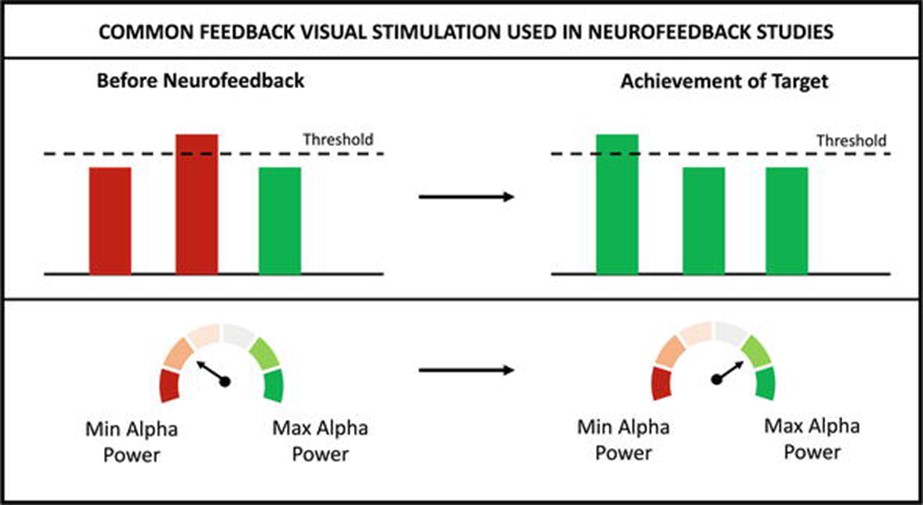
Graphique 2.
Représentation schématique du stimulus visuel fourni dans différentes études de neurofeedback.
5. Efficacité du neurofeedback dans la prise en charge de la douleur chronique
Plusieurs études de neurofeedback ont montré une réduction de la douleur suite au neurofeedback. Les principaux essais contrôlés randomisés dans le domaine ont été résumés dans Tableau 2. Une réduction de la douleur a été rapportée dans plusieurs conditions douloureuses telles que la fibromyalgie [27, 29, 36, 41], douleur neuropathique centrale chez les patients paraplégiques [28, 43, 47, 48, 49], Traumatisme crânien [39, 50], neuropathie périphérique induite par la chimiothérapie [51], Maux de tête primaires [52], syndrome douloureux régional complexe de type I [53], névralgie post-herpétique [37] et des douleurs lombaires chroniques [54]. Il existe un large éventail de réductions de la douleur signalées, qui peuvent aller d’une réduction moyenne de 6 à 82 % de l’intensité de la douleur [15]. Une revue systématique récente publiée a montré que dix des vingt et une études publiées sur le terrain ont rapporté une réduction de la douleur de plus de 30%, ce qui est considéré comme une réduction cliniquement significative [15].
Étudier | Douleur chronique | Oscillation cérébrale cible | % de réduction de la douleur | Les symptômes associés à la douleur s’amélioreraient après l’ONF |
Goldway et coll. (2019) [36] | Fibromyalgie | ↓ Activation de l’amygdale (IRMf) | 7% | Latence |
Prinsloo et coll. (2018) [50] | Neuropathie périphérique induite par la chimiothérapie | ↑ Alpha | 45% | Fatigue |
Guan et coll. (2015) [37] | Névralgie post-herpétique | ↓Activité du rACC (IRMf) | 64% | Aucun n’a été étudié |
Farahani et coll. (2014) [45] | Maux de tête primaires | ↑ SMR | 19% | Aucun n’a été étudié |
Caro et coll. (2011) [29] | Fibromyalgie | ↑ SMR | 39% | Fatigue |
Kayiran et coll. (2010) [40] | Fibromyalgie | ↑ SMR | 82% | Fatigue social Fonctionnement physique |
Tableau 2.
Essais contrôlés randomisés examinant le rôle du neurofeedback dans les conditions de douleur chronique.
Une telle variabilité dans le degré de réduction de la douleur pourrait être due à un certain nombre d’aspects du protocole de neurofeedback allant du nombre de séances, de la fréquence des séances, des fréquences cibles et des électrodes utilisées pour la rétroaction, par exemple. Les études de neurofeedback menées jusqu’à présent ont été très variables sur plus d’un de ces aspects [15, 16], rendant impossible la comparaison des résultats entre les études. Par conséquent, il est difficile de déterminer lequel de ces paramètres est responsable de la différence ou comment optimiser au mieux chacun de ces aspects de la formation.
La plupart des études de neurofeedback ont mesuré les changements dans la douleur immédiatement après le neurofeedback [39, 43, 52, 55, 56]. De plus, la réduction de la douleur a été signalée comme étant maintenue même lors d’un suivi de 3 à 6 mois après la fin de l’entraînement en neurofeedback [28, 36, 41, 49, 50, 51, 54]. Cependant, ces études n’indiquent pas si le changement correspondant du rythme cérébral qui a été mesuré après la fin de l’entraînement a également été maintenu lors du suivi à long terme. Nous ne connaissons pas la durée pendant laquelle l’effet du neurofeedback sur les rythmes cérébraux est maintenu. Fait intéressant, une étude a rapporté que, même si la réduction de la douleur ne s’est pas produite immédiatement après la fin du cours de formation, il y avait une amélioration de la douleur lors du suivi [36]. Cela pourrait suggérer que l’ONF pourrait peut-être entraîner des changements dans les réseaux cérébraux sous-jacents qui se produisent sur une plus longue période de temps, mais qui peuvent être maintenus pendant une plus longue période. Ces résultats fournissent les preuves préliminaires du potentiel du neurofeedback pour fournir une analgésie dans la douleur chronique.
Il a été démontré que le neurofeedback conduit non seulement à une réduction de la douleur, mais conduit à une amélioration d’un certain nombre de symptômes associés à la douleur tels que la dépression [27, 39, 41, 54, 57, 58, 59, 60], l’anxiété [27, 41, 54, 57, 59], la fatigue [27, 29, 41, 49, 51] et dormir [36, 39, 49, 50, 51, 57]. Ces symptômes sont connus pour coexister avec la douleur dans les conditions de douleur chronique et également connu pour exacerber la douleur de la personne sur une base quotidienne [61, 62, 63]. Par conséquent, en étant capable de cibler ces symptômes avec la douleur, le neurofeedback a le potentiel d’améliorer de manière holistique le bien-être de ces personnes. Un résumé des différents symptômes qui se sont améliorés à la suite d’un neurofeedback a été montré dans Graphique 3.
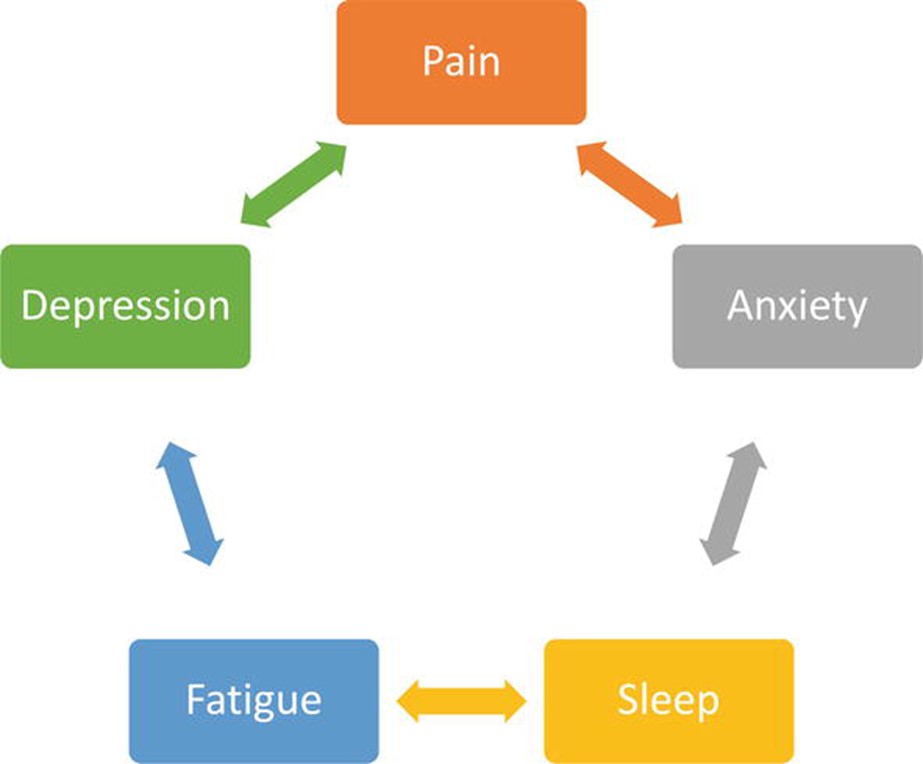
Graphique 3.
Représentation schématique de la douleur et des symptômes associés à la douleur dans les syndromes de douleur chronique.
Les études actuelles de neurofeedback ont un certain nombre de limites. Il n’y a actuellement que sept essais contrôlés sur le terrain [29, 41, 47, 51, 52, 64, 65], dont un seul essai est de haute qualité [65]. La plupart des essais ne comportent pas de mise en aveugle appropriée, car le groupe témoin est souvent composé de patients prenant d’autres analgésiques [29, 66]. Cela rend difficile la mise en aveugle du patient et pourrait conduire à croire que le patient croit au traitement affectant les résultats. Seules deux études ont mis en œuvre un neurofeedback simulé [36, 37].
Le meilleur traitement fictif à offrir est discutable. On pourrait soutenir que les patients pourraient recevoir le signal de rétroaction d’une autre région du cerveau. Mais ce n’est peut-être pas le mieux, car il se peut qu’une autre région utilisée pour la rétroaction soit la partie non découverte de la matrice de la douleur. Une autre façon de fournir une rétroaction factice serait de montrer à la personne l’enregistrement d’un autre participant ou son propre enregistrement dans l’ordre inverse. Bien qu’il puisse s’agir d’une véritable condition fictive, car la rétroaction montrée à l’individu serait indépendante de l’activité cérébrale de l’individu, cela pourrait signifier que les patients ne trouvent aucun soulagement des symptômes et découvrent qu’il s’agit d’un traitement fictif. Quoi qu’il en soit, un tel neurofeedback simulé doit être mis en œuvre par davantage d’études afin de vraiment comprendre si la réduction de la douleur rapportée chez ces personnes est due à des changements sous-jacents dans les réseaux neuronaux.
Bien que nous ayons beaucoup appris sur le neurofeedback au cours de la dernière décennie, il y a encore beaucoup d’inconnues sur cette technique. Le neurofeedback diffère des autres techniques neuromodulatrices telles que l’entraînement et la stimulation magnétique transcrânienne en ce sens que le neurofeedback implique une implication active des individus dans la modification des oscillations cérébrales, par opposition à la réception passive de la stimulation [5]. Nous ne savons pas encore laquelle d’entre elles est une technique plus efficace pour modifier les oscillations cérébrales. En outre, on ne sait pas non plus quelles stratégies mentales en particulier sont associées aux changements dans les oscillations cérébrales observés dans les études jusqu’à présent. Certaines des instructions courantes données aux patients en formation consistent à leur demander de rester détendus, d’imaginer des moments heureux, de revisiter des souvenirs heureux et de penser à leur membre de la famille ou à leurs amis préférés. Cependant, aucune des études jusqu’à présent ne documente laquelle de ces stratégies fonctionne réellement pour les patients. Par conséquent, d’autres études qualitatives sont nécessaires pour voir ce que les patients ont utilisé pour modifier activement leurs oscillations cérébrales pendant le neurofeedback afin de fournir des instructions plus ciblées aux patients en formation. En outre, les études devraient viser à analyser la corrélation entre le signal neurophysiologique et la réduction de la douleur plutôt que de se concentrer uniquement sur les résultats comportementaux [29, 41, 47, 51, 52, 64, 65]. L’établissement d’une telle corrélation entre le changement de comportement et les changements dans le signal neurophysiologique est essentiel pour comprendre si le soulagement de la douleur est vraiment dû au neurofeedback.
En plus de cela, il est également possible qu’une fois que les patients ont été en mesure d’identifier la stratégie mentale qui leur permet d’atteindre l’état cérébral souhaité et de pratiquer dans le cadre du neurofeedback pendant un certain nombre de séances, ils pourraient être en mesure de mettre en œuvre de telles stratégies mentales sans la rétroaction continue du signal EEG. Il n’est pas clair si cela est possible ou combien de temps il faudra pour qu’une personne devienne indépendante de la rétroaction EEG et reçoive toujours un soulagement de la douleur.
Les études actuelles de neurofeedback sont très hétérogènes. Il n’est pas clair quelles régions du cerveau, oscillations, forme de rétroaction ou durée d’entraînement sont nécessaires pour optimiser l’amélioration de la douleur. D’autres études sont nécessaires pour comparer un aspect du programme d’entraînement en neurofeedback à la fois afin de déterminer lequel de ces paramètres offre le plus d’avantages thérapeutiques.
Un autre domaine d’incertitude est l’efficacité du neurofeedback dans différentes conditions douloureuses. Jusqu’à présent, des études ont montré que toutes les douleurs chroniques signalent une réduction de la douleur dans une certaine mesure après un neurofeedback. Cependant, on ne sait pas si le neurofeedback est meilleur pour certaines conditions de douleur chronique que d’autres. Il se peut que les changements neuronaux observés à la suite du neurofeedback soient liés uniquement à la sensibilisation centrale, auquel cas plusieurs conditions de douleur chronique peuvent en bénéficier autant que de nombreuses conditions douloureuses en ont que la pathologie sous-jacente. Cependant, nous ne savons pas s’il est aussi efficace pour traiter la douleur nociceptive que dans des conditions telles que l’arthrite.
De plus, le rôle que le neurofeedback jouera dans la gestion de la douleur à l’avenir n’est pas clair [16]. Il n’est pas clair s’il a le véritable potentiel de remplacer complètement les agents pharmacologiques. Il se pourrait que cela réduise l’escalade de la consommation d’opioïdes dans cette cohorte de patients. Par conséquent, d’autres études sont nécessaires pour déterminer le potentiel maximal de cette forme de thérapie.
6. Effets indésirables associés au neurofeedback
En général, le neurofeedback est bien toléré avec une minorité de patients présentant des événements indésirables bénins. Ces événements indésirables sont souvent spontanément résolutifs et ont tendance à être contrôlés en diminuant la fréquence de l’entraînement [43, 48]. Les événements indésirables observés dans les études de neurofeedback semblent être plus fréquents dans certains groupes de patients que dans d’autres. Par exemple, certaines personnes atteintes de lésions de la moelle épinière et de douleurs neuropathiques centrales ont signalé une certaine hypersensibilité de la plante des pieds en raison de la récupération de la proprioception ou de spasmes du membre inférieur [28, 48]. Les patients atteints de lésions cérébrales traumatiques ont signalé une augmentation des nausées et de l’intensité de leurs maux de tête [39, 67]. Il est difficile de confirmer que ces effets secondaires sont dus à la ONF, car ces symptômes signalés sont souvent observés dans ces conditions, indépendamment de la prestation d’une thérapie de neurofeedback. Dans l’ensemble, l’ONF est sécuritaire et bien toléré chez la majorité des patients dans la plupart des études cliniques.
7. Prestation d’une thérapie de neurofeedback à domicile
Le neurofeedback a également été délivré à domicile par quelques études récentes [43, 48]. Cela peut être réalisé grâce à l’utilisation d’un casque qui enregistre l’activité d’une seule électrode, telle que C4 [43, 48] ou 1er PC [39] et utilise une application sur tablettes pour analyser et présenter les commentaires à la personne [28, 48]. De tels systèmes ont été mis en œuvre chez des patients souffrant de douleur neuropathique centrale [43, 48] ainsi qu’un traumatisme crânien [39]. Les patients pouvaient pratiquer le neurofeedback pendant des séances de 5 ou 10 minutes comme et quand ils le souhaitaient.
Ces études ont montré des résultats prometteurs. Avec l’expansion de cette technologie, il pourrait être possible pour les individus de bénéficier du neurofeedback à domicile au besoin, car les patients ont en moyenne utilisé le neurofeedback 3 à 40 fois au cours des 2 à 3 mois dans ces études [43, 48]. Deux de ces études ont rapporté une réduction d’environ 33% de la douleur [43, 48] alors que l’un d’eux a signalé une réduction de 16 % de la douleur [39] en moyenne chez les participants qui ont essayé ces systèmes à domicile.
L’une de ces études a également effectué une recherche qualitative sur l’expérience utilisateur à la suite de tels systèmes à domicile [43]. Dans l’ensemble, il a été signalé que le score de satisfaction des patients était élevé lorsqu’il était mesuré à l’aide du QUESB (Quebec User Evaluation of Satisfaction Questionnaire). Selon les patients, les facteurs clés qui ont affecté la fréquence de leur utilisation de l’appareil à domicile étaient leur état de santé, la disponibilité de temps libre et l’intensité de leur douleur. Les patients font également de l’efficacité, de la facilité d’utilisation et du confort leur principale priorité lors de l’utilisation d’un tel appareil à domicile. Ainsi, alors que la technologie domestique actuelle utilisée dans cette étude a montré qu’elle pouvait enregistrer les données avec une qualité décente, elle a également souligné que les patients voulaient une technologie capable de fournir un neurofeedback sans fil à l’aide d’un casque et d’un appareil intelligent, ainsi que de collecter des informations sur le cuir chevelu sans utiliser de gel pour connecter des électrodes.
Être capable de le faire sur une base régulière augmenterait également l’efficacité de la thérapie et les patients pourraient être en mesure d’utiliser le neurofeedback en plus ou à la place des agents pharmacologiques couramment utilisés qui sont associés à des profils d’effets indésirables importants. Par conséquent, le neurofeedback à domicile peut agir comme une nouvelle option de traitement pour soulager la douleur des patients avec beaucoup moins d’effets secondaires que les agents pharmacologiques actuels [68].
8. Conclusions
Le neurofeedback est une technique émergente qui peut être utilisée pour atteindre des états cérébraux associés à une résilience accrue à la douleur. Jusqu’à présent, les résultats ont été très prometteurs non seulement en termes d’amélioration de la douleur chronique, où jusqu’à la moitié des études dans le domaine ont montré une réduction cliniquement significative de la douleur clinique suite au neurofeedback, mais aussi en termes d’amélioration des symptômes associés à la douleur tels que la fatigue, la dépression, l’anxiété et le sommeil qui ont également été signalés pour améliorer avec le neurofeedback. Être capable de cibler toutes ces comorbidités de manière holistique en utilisant le neurofeedback est essentiel pour l’amélioration globale du bien-être des patients souffrant de douleur chronique, car ces facteurs sont souvent liés et s’aggravent mutuellement.
Il reste encore beaucoup de travail à faire. Différents aspects des protocoles d’entraînement, tels que le signal cible, le nombre de séances, la durée des séances et la région d’intérêt du cuir chevelu, doivent être optimisés afin d’identifier les paramètres qui conduisent non seulement à une modulation réussie de l’activité cérébrale, mais aussi à un changement correspondant des signaux de douleur. Actuellement, il n’est pas clair quel protocole de neurofeedback apporte un soulagement maximal de la douleur pour les patients.
En outre, l’identification de stratégies mentales permettant aux individus d’atteindre des états cérébraux thérapeutiques est également nécessaire, l’objectif étant que les individus puissent éventuellement pratiquer ces stratégies indépendamment du système de rétroaction après un premier cours de séances de formation. Bien qu’il y ait beaucoup de travail à faire, les résultats obtenus jusqu’à présent sont prometteurs, ouvrant une fenêtre d’opportunité pour gérer un certain nombre de douleurs chroniques à faible coût et sans les effets secondaires associés aux agents pharmacologiques actuellement disponibles.